In diesem Beitrag möchten wir spezielle Aspekte des Airwaymanagements hervorheben, die sich von Routinemaßnahmen unterscheiden. Hilfreich sind einige davon bei der Notfallnarkose und v.a. präklinisch (Link, Link). Fälle findet ihr hier und hier. Beatmung ist hier erklärt. Der Beitrag wird laufend erweitert, u.a. mit Case Reports.
Bailey-Manöver
Dabei handelt es sich um eine besondere Extubationstechnik, die ausschließlich durch erfahrene Anästhesisten angewendet werden darf. 1995 wurde sie von Dr. Paul Bailey, Anästhesist und Intensivmediziner aus Großbritannien, beschrieben. Im Kern wird vor der Narkoseausleitung eine Larynxmaske (LM) am noch intubierten Patienten eingeführt, gecuffed und der Tubus schließlich entfernt. Eine Modifikation wird unten beschrieben. Die Anwendung verbietet sich jedoch bei erhöhtem Aspirationsrisiko oder schwierigem Atemweg.
Das Problem ist, dass ein Trachealtubus von Patienten, die aus einer Narkose erwachen, regelhaft schlecht vertragen wird. Es kommt zu Husten, Würgen, Pressen, Kreislaufentgleisungen, Anhalten der Atmung und im schlimmsten Fall auch signifikanten Hirndruck- bzw. Augeninnendruckanstiegen und Nahtinsuffizienzen (Dehiszenz, Blutung). Das alles sind Effekte, die wir bei speziellen Patientengruppen einfach nicht haben wollen, nämlich z.B. nach Operationen am Gehirn, Auge, Schilddrüse oder im Bauch. Aus Erfahrung wissen wir, dass eine LM beim Aufwachen meist gar keinen Reiz darstellt. Der Patient blinzelt mit den Augen, öffnet auf Aufforderung den Mund und die LM wird gezogen. Das war also der Hintergedanke von Dr. Bailey. Tatsächlich zeigt die Datenlage, dass diese Idee mit Vorteilen für Patienten assoziiert ist (Link, Link, Link, Link, Link), da genau obige Probleme vermieden werden und die Inzidenz an respiratorischen Komplikationen gesenkt wird. Das Bailey-Manöver wird von der Difficult Airway Society (Link) bzw. der American Society of Anesthesiologists (Link) als Extubationsoption gelistet.
Mittlerweile gibt es eine modifizierte Methode, welche 2019 vorgestellt worden ist. Es wird nach Narkoseeinleitung eine LM eingeführt und gecuffed, dann bronchoskopisch intubiert und vor Narkoseausleitung der Tubus wieder entfernt, während die LM verbleibt. Vorteile sind u.a. ein weiterer Schutz vor Aspiration durch die LM, bronchoskopische Übungsmöglichkeit für den Arzt, Evaluierung der Atemwege sowie fehlende Atemwegsreizung am Ende der OP durch Neueinlage einer LM.
Double Trachea Sign
Leider ist die Inzidenz der ösophagealen Intubation nachwievor sehr hoch und wird mit ca. 8,4% beziffert (Link). Eine unerkannte ösophageale Intubation geht mit einer Letalitätsrate von 100% einher, da der Magen keinen Gasaustausch betreibt. Ausgenommen davon ist die bewusste ösophageale Intubation, siehe hier. Der sichere Nachweis der trachealen Lage des Tubus ist von größter Bedeutung. Zu den sicheren Intubationszeichen gehören unter anderem die Kapnographie / -metrie, Bronchoskopie und Laryngoskopie (Tubus zieht durch Glottis). Neu hinzugekommen – und zwar mit der S1-Leitlinie Atemwegsmanagement der DGAI erstmals im deutschsprachigen Raum – ist die Empfehlung, Ultraschall zur Verifizierung der korrekten trachealen Lage einzusetzen. Dazu wird mittels Linearschallkopf ein Querschnittsbild des Halses dargestellt. Den Tubus erkennt man am sog. Bulletsign.
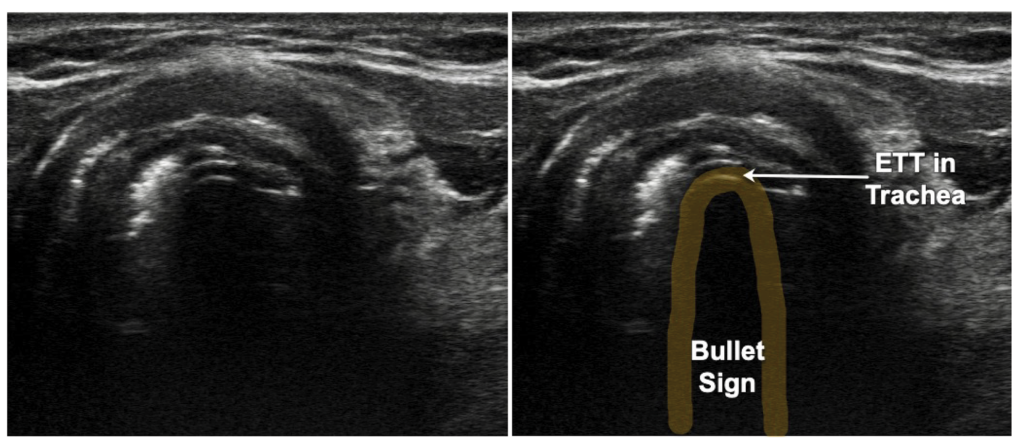
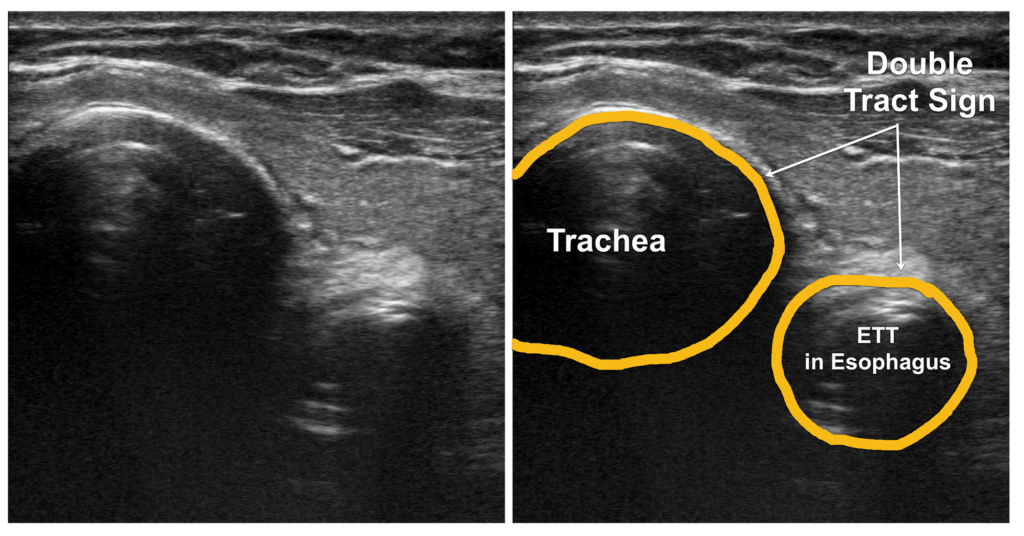
Eine ösophageale Intubation würde man wiederum anhand einer zweiten „Trachea“ erkennen, dem sog. Double Trachea oder Tract Sign:
Sollen wir somit eine korrekte Intubation immer mittels Ultraschall bestätigen? Nicht unbedingt. Der Goldstandard bleibt die Kapno, anhand derer man ja auch die Beatmung steuern kann. Außerdem ist es auch nicht zielführend, bei nicht kritischen, elektiven Intubationen den Ultraschall hinzuzuholen, um dann eine „0815-Intubation“ zu bestätigen. Jedoch ist anzumerken, dass die sonographische Bestätigung wesentlich schneller als die klinische Bestätigung mittels Auskultation und Kapnographie ist (Link, Link). Wo der Mehrwert aber definitiv zu sehen ist sind kritische Situationen, z.B. schwieriger Atemweg bzw. schwierige Intubation, Adipositas oder Reanimation (eine insuffiziente Herzdruckmassage bedingt keine Produktion von CO2), da die Platzierung des Tubus in der Trachea live verfolgt werden kann. Ebenso kann der Schall kurz auf den Hals gehalten werden, um rasch die korrekte Lage zu identifizieren. Dies ist durch die Datenlage mehr als bestätigt (Link, Link, Link, Link, Link). Im Übrigen kann der Ultraschall auch zur Kontrolle der Eindringtiefe des Trachealtubus dienen, denn normal belüftete Lungen weisen beidseits ein Pleuragleiten auf. Bei unibronchialer Intubation kommt es zum Kollaps der nicht belüfteten Lunge; dies zeigt sich sonographisch wie ein Pneu (fehlendes Pleuragleiten, CAVE: kein Lungenpunkt).
Ösophageale Intubation und SALAD
Wie uns allen bekannt ist, erfolgt die Platzierung eines Beatmungsschlauches (Trachealtubus, TT) in die Luftröhre. Dabei ist die Intubation in die falsche Röhre (Ösophagus) zu vermeiden und die Fehllage muss sofort erkannt werden (direkte Sicht, etCO2, Ultraschall), da ein Gasaustausch über den Magen nicht möglich ist. Aber darum soll es heute eigentlich gar nicht gehen. Es gibt Situationen des Atemwegsmanagements, die treiben selbst den erfahrensten Anästhesisten Schweißperlen auf die Stirn, insbesondere wenn es sich um eine Notfallnarkose handelt. Dazu gehört zum Beispiel unaufhörliches Erbrechen nach Narkoseeinleitung, z.B. bei zugrunde liegendem paralytischem Ileus. Okay, normalerweise wird vor Narkoseeinleitung bei Darmverschluss eine Magensonde gelegt, um den Magendarminhalt bis zur Sicherung des Atemwegs abzusaugen und somit eine Aspiration zu vermeiden, die z.B. zu einem ARDS oder Asphyxie führen kann. Sollte es nach Narkoseinduktion (diese führt zum Verlust von Schutzreflexen wie Husten, Schlucken, Würgen) zu einer passiven Regurgitation von Magendarminhalt kommen, so läuft dieser idealerweise über die Magensonde in ein Sackerl ab. Unter Umständen (d.h. wenn der Inhalt auch vorbeirinnt und sich ein See im Pharynx bildet) ist der zusätzliche Einsatz von Absaugkathetern notwendig, um eine orale Absaugung durchzuführen und die Aspirationsmenge zu reduzieren. Aber was soll man tun, wenn auch das nicht den gewünschten Erfolg bringt? Immerhin wird auch die Sicht durch Magendarminhalt erheblich beeinträchtigt. An sich gibt es die Meinung, dass solche Patienten nicht mit dem VL intubierbar sind, da die Kamera regelrecht zuläuft. Dies ist jedoch durch die Datenlage widerlegt (Link, Link, Link, Link), v.a. wenn die VL mit SALAD (s.u.) kombiniert wird.
Genau hier kommen wir zu einem Thema, wo viele Anästhesisten zuerst wahrscheinlich mal die Hände vor dem Gesicht zusammenschlagen würden: Die bewusste, gewollte und gezielte ösophageale Intubation mit einem Trachealtubus. Ja, ihr habt richtig gelesen. Eigentlich unvorstellbar, aber irgendwie doch auch logisch. Bei unstillbarem Erbrechen nach Narkoseeinleitung wird ein Beatmungsschlauch in den Ösophagus platziert, der Cuff aufgeblasen (zum Abdichten) und ein Absaugschlauch an den TT angeschlossen – ermöglicht wird dadurch ein effektives Absaugen von Magendarminhalt. Klingt nach einer Cowboy-Aktion. Ist es aber nicht. Es gibt dazu nämlich auch schon Fallberichte (Link) bzw. Simulationen von Anästhesisten, die die Effektivität nachgewiesen haben (Link), auch gegenüber der SALAD-Technik (Link). Die ösophageale Intubation musste ich z.B. bereits präklinisch bei der (frustranen) Wiederbelebung einer Patientin mit gastrointestinaler Blutung anwenden, da mit HDM des Sanitäters das Blut schwallartig in den Pharynx gedrückt wurde. Nach SALAD mittels Trachealtubus führte ich ihn in den Ösophagus ein und blockte ihn, wodurch das Blut über den Tubus in den Absauger gelang. In der Folge konnte ich die Patientin prompt und problemlos mittels Videolaryngoskop bei freier Sicht auf die Glottis mit einem neuen Tubus intubieren.
Ein weiterer interessanter Fall ereignete sich rezent, als ich in meinem Dienst akut informiert wurde, dass in wenigen Minuten ein 10-jähriges Mädchen mit akuter Blutung nach Tonsillektomie vor 1 Woche in den OP kommen würde. Also schnell im Kopf rechnen was ca. das Gewicht sein würde (~ 30 kg) und welchen Tubus (ID 6) ich verwenden würde. Ich informierte meine Pflege zur Bereitstellung von Videolaryngoskop, Spatel 3, 6er Tubus, großlumigem Sauger und Larynxmaske Größe 3. Im Kopf ging ich schnell die Medikamentendosierungen durch und kaum hatte ich die Substanzen aufgezogen wurde schon das Mädchen im Sessel sitzend von der Kinderärztin begleitend in den OP geschoben. In der Hand hielt es einen Nierentasse, in welcher mind. 100 ml Blut waren. Zusätzlich hatte sie vor 1h gegessen. Also komplexer und gefährlicher kann dann eine Narkoseeinleitung kaum mehr werden. Zwei anästhesiologische Oberärzte kamen zur Unterstützung hinzu und ich erklärte allen meinen Plan: Verbringen im Sitzen auf den OP-Tisch, Präoxygenierung im Sitzen, Einleiten im Sitzen, dann Rückenlage und Intubation unter SALAD. Ich kniete mich zu dem Mädchen, das im Übrigen 13 Jahre alt war (nicht 10), 35 kg wog und dtl. jünger aussah (als wäre sie 8J alt), nahm ihre Hand und erklärte ihr, dass jetzt ganz ganz viel um sie herum passieren würde, sie sich aber nur auf das Ausspucken von Blut und mich konzentrieren solle. Sie nannte mir noch ihren Namen und wurde dann mit den OP-Assistenten auf den OP-Tisch gesetzt. Einen Venenzugang hatte sie glücklicherweise bereits, worüber ich Glycopyrrolat 0,2 mg, Ondansetron 4 mg und Dexamethason 4 mg verabreichte. Nach Präoxygenierung mittels mehreren tiefen Atemzügen leitete ich die Narkose mit Alfentanil 0,6 mg, Propofol 150 mg und Succinylcholin 60 mg ein. Wir legten sie auf den Rücken und 30s nach Gabe des Relaxans führte ich das VL ein. Sofort stelle sich mir ein Blutsee dar, den ich mittels starrem Katheter rasch absaugte. Die Glottis sah ich unmittelbar, führte jedoch zunächst den Absaugkatheter links vom VL in den Ösophagus ein und intubierte dann unverzüglich die Trachea mit ID 6. Von Einfuhr VL bis Intubation vergingen ca. 8 Sekunden. Sodann gab ich das Mädchen für die Operation frei. Sie erhielt noch einen zweiten Zugang von mir, ebenso weitere Medikamente (Tranexamsäure 0,5 g, Sevofluran, Clonidin 30 mcg, Metamizol 0,5 g, Paracetamol 0,5 g, Kristalloid). Vor OP-Ende saugte mein Kollege noch 400 ml Blut aus dem Magen ab. Wir reden hier also von mind. 0,5 Liter Blutverlust! Bei geschätztem Blutvolumen von 80 ml/kg ergeben sich für das Mädchen sich ca 2,5l Gesamtblutvolumen, von dem 20% verloren gegangen sind! Meine Erkenntnisse aus diesem Fall: 1) SALAD ist elektiv zu beüben, damit man es im Notfall kompetent anwenden kann 2) Merkhilfen und Nachschlagwerke für Kinder sind wichtig, bei zeitkritischen und unvorbereiteten Notfällen aber zu ablenkend – grundlegende Formeln für Vitalwerte, Atemwegsmaterial und Medikamente müssen im Kopf gekonnt werden, auch im Notfall. Die Extubation gelang problemlos und nach 2h im Aufwachraum konnte sie mit glücklichen Eltern auf die Kinderstation verlegt werden.
DOPERS
Das DOPERS-Schema ist ein hervorragendes mentales Mnemonic, welches ich bei akuten Beatmungsproblemen stets abrufe, um der Ursache in Ruhe auf den Grund zu gehen. Nachdem man die FiO2 auf 100% gestellt und den Patienten von der Maschine an den Beatmungsbeutel genommen hat kann man es abarbeiten:

Ist eine mögliche Ursache erkannt so wird diese unmittelbar behoben. Dies möchte ich euch anhand eines Fallbeispiels erläutern. Rezent hatte ich ein erhebliches Beatmungsproblem bei einem schwer kranken Intensivpatienten mit akuter Pancreatitis und Ileus, welcher Tage zuvor operiert worden war. Ich übernahm den mittlerweile extubierten Patienten zum Wechsel seines Abdominal Dressings. Als Info erhielt ich von der übergebenden Kollegin, dass auf der ICU ein OptiFlow zur Aufrechterhaltung einer suffizienten Oxygenierung erforderlich war, da eine reine O2-Maske mit Reservoir nicht genügte. Wir erinnern uns: bei akuter Pancreatitis droht neben Pleuraergüssen, Begleitpneumonie und erhöhtem intraabdominellem Druck (Zwerchfellhochstand) auch die Entwicklung eines ARDS (akutes Lungenversagen).
Ich leitete die Notfallnarkose (Link) mittels Alfentanil, Etomidat und Rocuronium unter laufendem Noradrenalin ein und der Patient wurde durch einen notärztlichen Kollegen (absolviert regelmäßig Auffrischungstage im OP) prompt und problemlos intubiert. Doch sofort war ersichtlich, dass ein schweres Oxygenierungsproblem folgte – mit FiO2 100% und PEEP 7 cm H2O erzielte man lediglich ein SpO2 von 80% (verifiziert in der aBGA). Der Beatmungsdruck betrug 28 cm H2O. Ich rekrutierte den Patienten mehrmals und erhöhte den PEEP auf 10 cm, was zu einer bedingten und kurzfristigen Besserung führte (SpO2 94%). Ich informierte eine Oberärztin über den Zustand und machte mich mittels DOPERS auf die Ursachensuche:
- D – Kapnographiekurve ohne Haifischzacke (Ausschluss Bronchospasmus oder einseitige Intubation), Thorax eindeutig beidseits hebend
- O – Absaugen des Tubus bland
- P – im Sono keine Hinweise auf Pneu, bdsts Pleuraergüsse (nicht punktionswürdig)
- E – keine Hinweise auf Maschinenfehler
- R – Patient mit Rocuronium maximal relaxiert
- S – Magen vor RSI abgesaugt mittels Magensonde, Bauch eröffnet (kein abdominelles Kompartmentsyndrom)
Während die Chirurgen mit der OP starteten ließ ich mir das Bronchoskop holen und führte eine Notbronchoskopie durch. In dieser stellte ich v.a. in den Unterlappen (li > re) zähig-schleimige Veränderungen fest, welche ich mittels sterilem Aqua gut mobilisieren und absaugen konnte. Danach rekrutierte ich die Lungen des Patienten erneut (-> Absaugen durch Bronchoskop kann Atelektasen bedingen) und stellte den PEEP nun auf 18 cm H2O gemäß ARDSnet Trial Tabelle ein. BGA: PaO2 ~ 100 mmHg (Katastrophe mit diesen Einstellungen!) Das Tidalvolumen beließ ich auf 400 ml (6 ml/kg Idealgewicht – lungenprotektiv). Ich verbrachte den Patienten nach Eingriffende intubiert-beatmet zurück auf die Intensivstation. Im Folgegas konnte bereits ein PaO2 von 240 mmHg festgestellt werden, d.h. meine Maßnahmen hatten zu einer Besserung geführt – langsam wurde daher eine Entwöhnung von den Beatmungsparametern versucht. Ein Thoraxröntgen wies die bereits bekannten Pleuraergüsse nach wie auch den Verdacht auf eine entzündliche Komponente basal (li > re) – ARDS beginnend?
Wir halten fest: Beatmung von schwer kranken Intensivpatienten ist hochkomplex, insbesondere wenn Probleme auftreten und die Ursachensuche keine klaren Ergebnisse mit sich bringt. Man stelle sich vor solch eine lebensbedrohliche Oxygenierungsstörung wäre im präklinischen Setting im Notarztdienst unmittelbar nach Narkoseeinleitung passiert, wo die Diagnose-, Hilfe- und Unterstützungsmöglichkeiten erheblich eingeschränkt sind. Das lässt auch den erfahrensten Notarzt nicht kalt. Der regelmäßige Umgang mit künstlich beatmeten Patienten wie auch den verschiedenen Devices (Tubus, Larynxmaske, Bronchoskop, …) ist der einzige Weg, Patienten sicher durch eine Narkose(einleitung) zu führen.
Schreibe einen Kommentar