Im heutigen Beitrag möchte ich euch einen groben Überblick über Themen, welche die (präklinische) Reanimation der Zukunft betreffen, liefern. Manche werden im Alltag bereits angegangen bzw. umgesetzt, doch ist teilweise eine inflationäre Schulung bzw. Anwendung zu beobachten. Atemweg bei CPR wird hier behandelt, Reanimation in Bauchlage hier.
CPR-IC
CPR-Induced Consciousness ist eine immer mehr in den Vordergrund rückende Thematik, seitdem immer mehr Fallberichte zutage kommen, bei denen Patienten während einer Reanimation wach und kontaktierbar imponierten. Ich habe dies bisher einmal erlebt. Zugrunde liegend ist eine sehr effiziente Herzdruckmassage (HDM), die eine potente Cerebralperfusion sicherstellt (gutes prognostisches Zeichen). Dies kann für Laien oder Personal irritierend wirken. Wird mit der HDM aufgehört ist der Patient unverzüglich bewusstlos (da reanimationspflichtig). CPR-IC kann dermaßen ausarten, dass sich Patienten nicht behandeln lassen oder gegen medizinische Maßnahmen wehren. Hier sind dann Narkoseeinleitung und Relaxierung zwingend nötig (Link), z.B. mittels Opioid, Midazolam, Esketamin und Rocuronium. Mittlerweile wurden Empfehlungen zum Umgang mit CPR-IC publiziert (Link). Der ERC erwägt in seinen 2025er GL die Gabe von Analgosedativa an Patienten, die wach imponieren oder deren Wachheit nicht ausgeschlossen werden kann. Natürlich wissen wir aber auch, dass Patienten mit CPRIC vmtl. zügiger zu einem sustained ROSC kommen, ev. sogar ohne erweitertes Airwaymanagement. Was ich sagen will: imponiert eine Person wach (Augen öffnend, Laute) während einer CPR und ist diese CPR erst von kurzer Dauer, so würde ich persönlich nicht sofort eine Analgosedierung +/- Relaxierung verabreichen (ausgenommen physische Behinderung der CPR), da ich mir dann definitiv ein Airwaymanagement einkaufe und der Patient ein Intensivbett braucht, obwohl er vlt keines gebraucht hätte, wenn man nach kurzer Zeit CPR unter milden CPRIC-Zeichen (Augen öffnend, Laute) einen ROSC mit Bewusstsein und spontaner Atmung erzielt hätte.
Head-Up CPR
Die HDM hat beim nicht-traumatischen Kreislaufstillstand absolute Priorität und wird primär am flachen Patienten durchgeführt. Rezent rückt die HDM am Patienten mit 30° erhöhten Oberkörper in den Vordergrund. Die Idee dahinter ist eine Senkung des Hirndrucks (ICP) durch Verbesserung des venösen Abflusses mit Harmonisierung der Hirndruchblutung und Verlagerung von Liquor nach spinal. Es gibt Hinweise, dass die Head-Up CPR mit erhöhten ROSC-Raten und einem besseren Neurooutcome assoziiert ist (Link, Link, Link, Link). Die Datenlage ist noch viel zu schwach, daher stellt der ILCOR fest, dass eine weitere Erforschung nötig ist.

Pseudo-PEA
Unter Pseudo-PEA versteht man ein EKG, welches mit dem Leben vereinbar ist, klinisch aber keinen peripher tastbaren Puls produziert (da der Blutdruck sehr niedrig ist). Seit den 1990er Jahren ist bekannt, dass ein palpatorischer Pulscheck mittels Finger nicht sensitiv zur Detektion eines ROSC ist (Link, Link, Link). Somit müssen insbesondere im ALS (und im Jahr 2025) alternative Wege gesucht werden. Eine Pseudo-PEA kann primär auf drei verschiedene Wege entlarvt werden: Kapnographie (Nachweis von etCO2 > 20 mmHg, Link), invasive Blutdruckmessung (pulsatile Welle, niedrige Blutdruckwerte -> Goldstandard – jedoch CAVE arterielle Punktion unter CPR extrem schwierig, auch mit Ultraschall -> ich persönlich steche während der Analysephase oder unterbreche die HDM für max. 5 Sekunden für die ultraschallgezielte Punktion) oder Ultraschall (primär Echocardiographie mit transthorakaler Sonde zum Nachweis von Kontraktionsmustern, besser jedoch transösophageal wie bereits in Deutschland von den MIC-Notärzten angewandt, da bessere Bildqualität und zusätzlich Optimierung des Druckpunkts möglich, Link, Link). Ebenfalls möglich ist ein Schall der A. carotis communis (Link, Link, Link, Link) bzw. A. femoralis (bedingt ideal, v.a. bei Adipositas) – ein Nachweis einer pulsatilen Kontraktion (visuell nach vollständiger Kompression der Jugularvene und Teilkompression der Carotis oder auch mittels Pulsed Wave Doppler) entspricht einem ROSC und ist deutlich verlässlicher als die Echocardiographie (aus dem Kontraktionsmuster ist nur bedingt ein pulsatiler Fluss ableitbar, Echocardiographie unter CPR sehr komplex und interferriert ev. mit Wiederbeginn der Herzdruckmassage). Die Therapie besteht in der vorsichtig titrierten Gabe von Push-Dose-Pressoren (Link) wie z.B. Adrenalin (Supra Blitz), zügig gefolgt von z.B. einem Noradrenalin-Perfusor. Des weiteren kann der Ultraschall zur Auffindung reversibler Ursachen, Unterstützung bei Gefäßpunktionen und auch der Tubuslage dienen. Ich persönlich setze im Notarztdienst eine Arterie (ultraschallgezielt) nur dann, wenn die Reanimation erfolgversprechend wirkt; dann untersuche ich aber auch zügig das Herz mittels Ultraschall.
Esmolol
Esmolol ist ein β1-Blocker – Details findet ihr hier. Es gibt derzeit Überlegungen, ob es einen Stellenwert bei therapierefraktärem Kammerflimmern (KF) spielen könnte. Dies ist darin begründet, dass neben der Grunderkrankung (z.B. OMI) auch das eingesetzte Adrenalin proarrhythmisch wirkt. Eine Durchbrechung erscheint neben der Defibrillation und dem Antiarrhythmikum Amiodaron bzw. Lokalanästhetikum Lidocain möglicherweise dann doch mit dem Gegensatz zu Adrenalin, also Esmolol, zu gelingen. Das Problem: kleinere Arbeiten (Link, Link, Link) zeigen zwar erhöhte ROSC-Raten, diese sind aber statistisch nicht signifikant. Die Anwendung verbleibt daher experimentiell.
DSED
Eine weitere Möglichkeit bei therapierefraktärem KF scheint der Einsatz von zwei (!) Defibrillatoren zu sein. Diesem Thema widmete sich eine Arbeitsgruppe aus Kanada und untersuchte, ob eine Dual Sequential Defibrillation (DSD, d.h. zusätzlich zur konventionellen Positionierung der Defielektroden werden noch zwei Elektroden anterio-posterior geklebt) bzw. eine Änderung des Vektors (Vector Change Defibrillation ~ VCD, d.h. die konventionellen Elektroden werden während der Reanimation auf anterior-posterior umgeklebt) zu einer besseren Durchbrechung des KF führen kann. Es konnte gezeigt werden, dass die Anwendung der DSD oder VCD zu einer besseren Terminierung des KF, erhöhter ROSC-Inzidenz und erhöhter Überlebensrate der Patienten bis zur Entlassung geführt hat. Eine rezente Metaanalyse wiederum konnte einen eindeutigen Benefit nicht nachweisen. Aufgrund des Mangels an Daten kann eine generelle Empfehlung für DSD oder VCD noch nicht ausgesprochen werden. Zum einen sind nicht immer zwei Defibrillatoren verfügbar, zum andern kann das Vorhandensein zweier Geräte zu Verwirrung führen. Auch an der mangelnden Zulassung des Herstellers kann es scheitern, wobei z.B. Corpuls-Defibrillatoren diesbezüglich anwendbar sind (Link). Praktikabler scheint derzeit am ehesten der Wechsel auf anterior-posterior zu sein. Rezent gibt es vom ILCOR eine schwache Empfehlung für DSD bzw. VCD (Link). Der ERC spricht sich 2025 gegen eine Routineanwendung von DSD aus, VCD kann nach dem 3. erfolglosen Schock probiert werden.
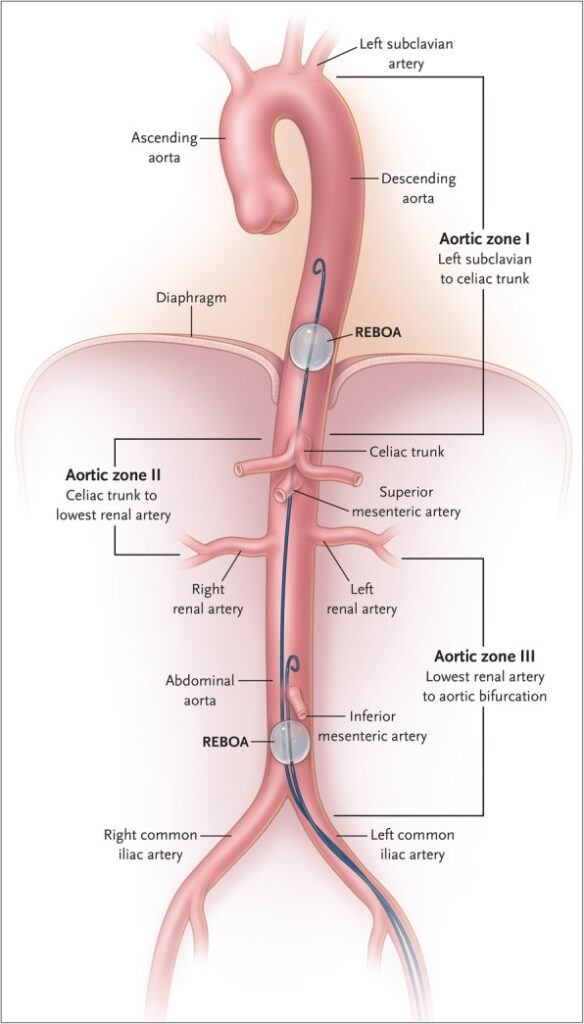
REBOA
REBOA steht für Resuscitative Endovascular Balloon Occlusion of the Aorta, d.h. es wird ultraschallgezielt die A. femoralis punktiert und darüber ein zu blockender Ballonkatheter auf das gewünschte Niveau eingeführt (Zone 1 oder 3). Primär dient dies der Blutstillung im Rahmen von Abdominal- oder Beckentrauma. Innerklinisch kam ich mit REBOA bisher einmal in Kontakt, als ich eine Akutnarkose für eine massive Leberblutung durchführen musste. Im präklinischen Setting ist London HEMS hierfür allseits bekannt (Link), wobei die Fallzahlen dort auch niedrig sind. In Deutschland wird das Set von ausgewählten Notarztmitteln bereits mitgeführt.
Das UK REBOA Trial (Link), welches gerne als Ende der REBOA insgesamt zitiert wird (da erhöhte Mortalität im Patientenkollektiv), ist ein typisches Beispiel von „viel Meinung, wenig Ahnung“, da es sich um eine innerklinische Studie handelte (das hat also nichts mit Präklinik zu tun). Die Patienten waren teils 1h prähospital unterwegs, bevor sie den Schockraum erreichten (somit ist ein Benefit von REBOA wohl kaum zu erwarten, da schon eine Menge Blut verloren gegangen ist). Zusätzlich war das durchführende Personal ungeübt in der Anlage (teils > 30 Minuten Anlagezeit), weniger als die Hälfte der Patienten der REBOA-Gruppe erhielt tatsächlich eine REBOA eingelegt und es gab auch eine große Anzahl an Fehl- oder gescheiterten Kannülierungen.
Beim nicht-traumatologischen Kreislaufstillstand ist die Idee, das infradiaphragmale Gebiet von der Blutversorgung auszuschließen und die Versorgung von Hirn und Herz zu maximieren. Kleine Arbeiten haben sich bereits damit befasst (Link, Link). Es ist jedoch zu berücksichtigen, dass man sich dafür potentiell ein Versagen aller Abdominalorgane wie auch des Rückenmarks einkauft.
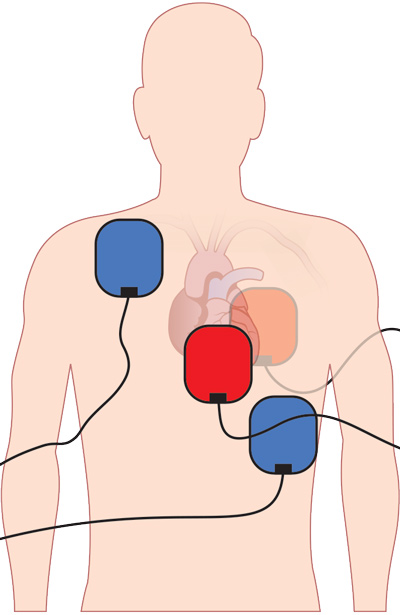
eCPR
Darunter versteht man die extracorporale CPR, d.h. mittels einer ECMO-Maschine (extracorporale Membranoxygenierung) wird extern die Herz- und Lungenfunktion während der Reanimation übernommen. Dies als VA-ECMO, d.h. z.B. großlumige ultraschallgezielte Punktion von V. femoralis und A. femoralis. Seit der Erwähnung in den ERC-Leitlinien 2021 ist der Fokus darauf größer geworden, sodass eCPR nicht nur innerklinisch angeboten wird (siehe Leitfaden), sondern mittlerweile auch präklinisch (siehe London, Paris, Prag, Heidelberg usw.). Klar ist, dass die Datenlage diesbezüglich noch spärlich ist (Link, Link, Link) und dass einzelne Patientengruppen davon sicher profitieren könnten. Das Identifizieren dieser (wie auch der Zeitfaktor – eCPR sollte < 1h nach Onset etabliert sein) macht das Ganze dann doch sehr schwer. Weiters braucht es hochspezialisierte ärztliche Teams, welche zusätzlich zum Regelrettungsdienst mitalarmiert werden (bestenfalls Parallelalarmierung). Bis das ganze System flächendeckend verfügbar ist wird noch eine ganze Weile vergehen.

Clamshell-Thorakotomie
Auch die CT wurde in den ERC-Leitlinien 2021 erwähnt und erhielt daher auch besonderen Fokus. Im Kern erfolgt das Eröffnen des Brustkorbs noch am Einsatzort, was vom Aussehen dann einer aufgeklappten Muschel (~ Clamshell) ähnelt. Ziel sind die Blutstillung wie auch Übernaht von Löchern (z.B. Herzpenetration) und Aortendruck (Idee ähnlich REBOA – Maximierung Hirn- und Herzperfusion).
Angefangen haben damit die Londoner Notärzte bereits in den 1990er Jahren. Ihre Erkenntnisse sind von entscheidender Bedeutung für die heutige Datenlage. Dieses Jahr veröffentlichten sie solche aus 21 Jahren CT (Link). Spannend ist zunächst die Patientenanzahl von 601 – pro Jahr im Schnitt also 28 Patienten (macht 2-3 im Monat). Und CAVE: wir reden hier von einem Notarzthubschrauber, der ein Gebiet von ca. 10 Millionen Menschen abdeckt. Und London hat eine hohe Stabbing-Inzidenz, d.h. die Wahrscheinlichkeit dort auf das Patientengut zu treffen ist im Vergleich relativ „hoch“. 90% der Patienten hatten ein penetrierendes Trauma. Ihre Erkenntnis: primär profitiert die isolierte Herzbeuteltamponade von einer CT (kein Mortalitätsunterschied ob penetrierend oder stumpf). Und: Zeit ist ganz wichtig – so rasch es geht. Patienten mit Exsanguination aus anderen Gründen hatten so gut wie keine Überlebenschance. London HEMS führt zwar Blutprodukte mit (CT ist eine Massivtransfusionsindikation), aber bis diese tatsächlich im Patienten angelangen vergeht einfach Zeit. Interessant: bis zur Spitalsentlassung überlebten letztlich 30 Patienten (5%), davon hatten 23 ein zufriedenstellendes Neurooutcome.
Fazit: Clamshell ja, aber nur durch trainierte Notärzte in einer „High Incidence“ Umgebung für potentielle CT-Kandidaten. Jeden Notarzt in einen kurzweiligen Kurs zu setzen und dann zu erwarten, dass dieser bei wenigen NEF-Diensten im Jahr in einer „Low Incidence“ Umgebung dann plötzlich eine CT durchführen soll stellt für mich persönlich nicht ein Erfüllen eines geforderten E des ERC (Expertise) dar. Zusätzlich müssen Blutprodukte mitgeführt werden. Besser wäre es meiner Ansicht nach, wenn man ähnlich zu Deutschland sog. Medical Intervention Cars (MIC) entwickelt (mit Einbindung der Notarzthubschrauber), welche von Ärzten besetzt sind, die sich nur mit hochkomplexen präklinischen Maßnahmen beschäftigen, diese regelmäßig beüben und sie dann auch präklinisch durchführen. Wenn London das für 10 Millionen Einwohner mit einem Hubschrauber schafft, dann werden wir das in Österreich mit > 25 Notarzthubschraubern für 9 Millionen Einwohner hoffentlich auch schaffen.
Adrenalin
Unser Abschlussthema möchte ich mit einem Gedankengang beginnen. Glaubt ihr macht es Sinn, dass wir jeden (erwachsenen) Patienten in der Reanimation vollkommen unabhängig von der Genese des Kreislaufstillstands, Vorerkrankungen und Alter / Gewicht mit derselben Dosis Adrenalin in demselben Intervall behandeln? Ich glaube die Antwort erübrigt sich hier von selbst. Die Benchmark jeglicher erfolgreichen Reanimation ist das neurologische Outcome bei Spitalsentlassung (z.B. mod. Rankin-Skala ≤ 3). Problem: Adrenalin ist mit einem schlechten Neurooutcome assoziiert (Link, Link, Link, Link, Link, Link). Tatsächlich ist es daher nicht verwunderlich, dass die neuen ERC 2025 LL eine individuelle Adrenalin-Dosierung (initial max 0,1 mg abhängig vom Blutdruck in der invasiven Messung) empfehlen. Leider hat man sich immer noch nicht getraut, der 1 mg Monsterdosis Adrenalin endgültig den Garaus zu machen. Ein Benefit auf das Neurooutcome ist laut ERC nicht belegt. Beim traumatischen Kreislaufstillstand scheint undurchdachtes Adrenalin ebenfalls keinen Mehrwert zu bieten – am ehesten ist der Benefit noch beim neurogenen Kreislaufstillstand zu erwarten (Link, Link). So ist z.B. bei CPR im OP-Saal laut UK RC (Link) eine niedrige Dosis von Adrenalin empfohlen (50-100 mcg), um Blutungen im chirurgischen Gebiet nicht zu provozieren / zu verstärken. Eine OP – v.a. wenn sie ausgedehnt ist – stellt ein signifikantes Trauma dar; insofern ist es verwunderlich, wieso bei chirurgischen Eingriffen eine niedrigere Adrenalin-Dosis postuliert wird, beim Trauma-HKS ist es dann aber plötzlich egal, dass man 1 mg spritzt. Ich persönlich meide Adrenalin bei jungen Patienten mit tachyrhythmogenem Kreislaufstillstand – Hand aufs Herz: welchen Sinn hat ein proarrhythmogenes Medikament bei einem Patienten mit z.B. FBI , Bundgaard-, TWA– oder Brugada-KF? Eine rezente retrospektive Arbeit aus Paris stellte fest, dass ein leitlinienkonformes Geben von Adrenalin mit einer schlechteren (!) Prognose assoziiert ist und eine Verzögerung oder Nicht-Gabe mit einem besserem Outcome assoziiert ist (Link). Sowohl ROSC-Rate (21%), 30-Tage Überleben (1,6%) und ein gutes Neurooutcome (1,2%) waren in der leitliniengerechten Adrenalingabe am niedrigsten. In Zukunft wird es wohl eine spezifische Gabe von Adrenalin postuliert werden (z.B. CPR-pflichtige Anaphylaxie, Überdosis mit Sympatholytika, Arrest aufgrund neurogenem Schock etc).
Fazit
Selten habe ich so einen langen Artikel geschrieben – aber er ist doch ungemein spannend wie ich finde. Die Reanimation der Zukunft wird uns alle noch mehr fordern. Dies ist nötig, da unsere Patienten immer kränker, älter und auch komplexer werden. Die Beschneidung der notärztlichen Indikationen (siehe z.B. den Katalog des DBRD) ist zwingend erforderlich, damit der Notarzt für die Patienten da sein kann, die seine Expertise wirklich benötigen und davon auch profitieren. Gleichzeitig müssen die erweiterten notärztlichen Maßnahmen auch in der (Notfall)Sanitäterausbildung angeschnitten und vorgestellt werden, damit jedem bewusst ist, was einen am Notfallort im Rahmen einer Wiederbelebung erwarten könnte. Klar ist, dass wir in Zukunft einen Haufen Material zu sehen bekommen werden, unter anderem auch Blutprodukte sowie großlumige zentralvenöse Zugänge (siehe diese Arbeit des MIC-Teams Heidelberg). Doch wir dürfen niemals vergessen: BLS vor ALS!
Schreibe einen Kommentar