In diesem Beitrag findet ihr eine Auflistung von speziellen Krankheitsbildern, die in der Notfallmedizin nicht unbedingt die Aufmerksamkeit haben, die ihnen eigentlich zusteht.
BRASH-Syndrom

β-Blocker wie Bisoprolol, Metoprolol oder Nebivolol gehören zu den am häufigsten verschriebenen Medikamenten. Indikationen sind unter anderem die cHI, KHK, aHT oder Migräneprophylaxe. Akut finden sie ihre Anwendung insbesondere bei Tachyarrhythmien (siehe Esmolol, Labetalol, Landiolol, Metoprolol).
Die Blockade von kardiorenalen β1-Rezeptoren bedingt Bradykardie und Hypotonie (Schlagvolumen ↓, Renin-Freisetzung ↓), die Inhibition von β2-Rezeptoren kann zu Bronchospasmus und Hypoglykämie (Hemmung der hepatische Glykogenolyse und Glukoneogenese) führen. Verkompliziert wird das durch gleichzeitige Blockade von α1-Rezeptoren (z.B. Carvedilol). Das Vollbild einer Intoxikation kann daher einem kardiogenen Schock mit Bradyarrhythmie, Hypotonie, redAZ bis Bewusstlosigkeit und Hypoglykämie entsprechen. Das EKG kann schwerste Bradyarrhythmien bis hin zum AVB3 zeigen, bei Propranolol ist die Entwicklung eines Brugada-Patterns durch Blockade von Natriumkanälen möglich.
Eine Besonderheit ist das BRASH-Syndrom, welches erstmals 2016 beschrieben worden ist (Link). Es umfasst Bradykardie, Renales Versagen, AV-Blockade, Schock und HyperK (Link). Der Pathophysiologie zugrunde liegend ist zumeist ein akuter Nierenschaden (acute kidney injury ~ AKI), der zur verminderten renalen Elimination von therapeutisch optimal eingestellten AV-Blockern (Beta-Blocker, Calcium-Antagonisten) führt. Aggraviert wird das ganze durch eine HyperK, bedingt durch AKI und auch Beta-Blocker (-> Blockade der Na-K-ATPase). Eine zusätzlich Einnahme von ACE-I oder ARB verstärkt die HyperK natürlich. Es drohen fatale Arrhythmien. Die Bradykardie und Hypotonie bzw. letztlich Schocksymptomatik (merke: Schock ist nicht Hypotonie, Link) führen zu einer weiteren Minderperfusion der Nieren und Förderung der Schädigung. Es entsteht ein Teufelskreis, welcher zügig durchbrochen werden muss. Die Therapie erfolgt symptomatisch und fokussiert sich auf Behandlung der Bradykardie (siehe Atropin, Glycopyrrolat, Adrenalin, Schrittmacher), HyperK (Lokelma, Salbutamol, Insulin-Glucose, Calcium ~ umstritten, Link) und AKI (z.B. Rehydratation, wenn Hypovolämie Ursache ist; ultimativ Dialyse). Der Furosemid-Stresstest (Link) kann erwogen werden, um die Notwendigkeit einer künftigen Dialyse abzuschätzen. Der Blutzucker muss engmaschig überwacht werden, da eine Überdosis mit Beta-Blockern zu Hypoglykämie, eine Überdosis mit Calcium-Blockern zu einer Hyperglykämie führt.
Therapeutisch sind bei β-Blockerintoxikation je nach Schwere folgende Maßnahmen zu treffen:
- falls notwendig Sicherung des Atemwegs bzw. CPR
- Aktivkohle 0,5-1 g/kg p.o. (< 1h)
- Kreislaufstabilisierung mittels Adrenalin, Noradrenalin, Dobutamin, Atropin, Flüssigkeit
- Glucagon 5-10 mg i.v., ev 10 mg/h i.v. → führt zu intrazellulärem cAMP-Anstieg mit Calcium-Einstrom → positiv chronotrop, dromotrop und inotrop (kaum Evidenz)
- Insulin-Glukose (Dosisangaben uneinheitlich, empfohlen wird zB Insulin 1 IE/kg i.v. mit Glucose 30 g i.v., gefolgt von 0,5-10 IE/kg/h i.v. und Glucose 30 g/h i.v. je nach Wirkung; siehe hier) → Insulin scheint durch Verbesserung der Stoffwechsellage in den Kardiomyozyten die Pumpleistung zu verbessern (Link, Link)
- Calcium (z.B. 3A Calcium-Gluconat)
- Lipid-Rescue 1,5 ml/kg i.v., dann 0,025 ml/kg/min i.v. (→ Wirkmuster unklar, ev Abdiffusion des β-Blockers, Aktivierung von Kanälen am Myocard, Substrat für Herzmuskelzellen; Link, Link)
- Natrium-Bicarbonat 1-2 mmol/kg i.v. besonders bei breitem QRS-Komplex
- Spezielles wie vorübergehendes Pacing, ECMO, intraaortale Ballonpumpe ua.
SCAPE

SCAPE steht für „Sympathetic Crashing Acute Pulmonary Edema“ und bezieht sich somit auf ein cardiales Lungenödem aufgrund einer hypertensiven Entgleisung. Es handelt sich um eine Form des hypertensiven Notfalls und ist daher akut behandlungsbedürftig. Als Ursache kommt z.B. eine Non-Adhärenz mit einer antihypertensiven / antiherzinsuffizienten Therapie in Frage, was zu einem reflektorischen akuten Blutdruckanstieg führt. Auch eine Intox mit Cocain ist als Ursache möglich. Die Patienten präsentieren sich agitiert, tachydyspnoeisch, hypoxisch (Lungenödem), tachycard und hypertensiv. Beinödeme finden sich nicht, da der Catecholaminsturm zu einer Verlagerung des Blutes in die Lungenstrombahn führt. Unbehandelt führt das Krankheitsbild zum Tode, da die Patienten schwer kompromittiert sind.
Die Therapie des SCAPE hat unmittelbar und aggressiv zu erfolgen (Link, Link):
- zügig hochtitrierte CPAP- (5-15 cm H2O) oder NIV-Therapie (EPAP 5-10 cm H2O, IPAP 10-15 cm H2O), Link
- Glyceroltrinitrat: Beginn Perfusor mit 0,1-0,8 mg/min (beschrieben ist auch Bolus 0,5-1 mg i.v., wovon ich persönlich aber Abstand nehmen würde bis die Datenlage ausgereifter ist)
- Alternativen / Ergänzung: Glyceroltrinitrat 0,8-2 mg s.l. (2-5 Hübe!), Urapidil 25-100 mg i.v., Clevidipin 1-5 mg/h i.v.
Die Therapie wird zügig herabtitriert, sobald eine deutliche klinische Besserung eintritt (verbesserte Oxygenierung, Blutdrucknormalisierung). Meist lassen sich Patienten innert 1h stabilisieren. Die hohe Dosis von GTN / Nitro ist notwendig, da es nur dann auch arteriell wirkt (es ist primär ein Venodilatator). Beachte, dass Opioide wie Morphin bzw. Piritramid oder Benzodiazepine wie Midazolam keinen primären Stellenwert haben, aber zur respiratorischen Therapie / Anxiolyse niedrigdosiert verabreicht werden können, v.a. da beide Medikamentengruppen antagonisierbar sind (Naloxon, Flumazenil). Das Diuretikum Furosemid hat keine Bedeutung in der Therapie von SCAPE, da das Lungenödem nicht aufgrund Hypervolämie, sondern aufgrund des Hypertonie-induzierten Linksherzversagens bedingt ist (Link).
Kawasaki-Syndrom
Das Kawasaki-Syndrom (Link) betrifft besonders Kinder < 5 Jahren und kann unbehandelt zum Tod durch ein akutes Coronarsyndrom führen. Dabei handelt es sich um eine generalisierte entzündliche Gefäßerkrankung (Vasculitis), deren Ätiologie und Pathophysiologie noch nicht zur Gänze verstanden ist. Im Kern kommt es zu einer pathologischen Aktivierung des Immunsystems mit Infiltration der Gefäßwände, Inflammation, Thrombosierung und im Extremfall Aneurysmabildung. Diese Aneurysmabildung ist v.a. cardial an den Arterien evident (betrifft 25% der unbehandelten Kawasaki-Patienten) und kann in den folgenden Jahren bis Jahrzehnten zu gravierenden Komplikationen führen (dazu später). Die Erkrankung ist grundsätzlich auch ohne Therapie selbstlimitierend.
Der Symptomkomplex umfasst laut dem 2024 Update der AHA (Link):
- Fieber (mind. 5d; > 38,5°C, oft therapierefraktär)
- Conjunctivitis
- gerötete Schleimhaut (Erdbeerzunge), brüchige Lippen
- geschwollene Lymphknoten am Hals
- generalisiertes Exanthem
- Ödeme bzw. Hautablösung an den Extremitäten
Beachte, dass all diese Symptome nicht immer gleichzeitig vorliegen. Denke daher bei jedem Kind mit generalisiertem Krankheitsgefühl, neuem Exanthem und therapierefraktärem Fieber an das Kawasaki-Syndrom! Die Diagnose erfolgt grundsätzlich klinisch, bei Unklarheit kann sie durch ein Herzecho unterstützt werden.
Die Therapie erfolgt hauptsächlich mittels ASS (Reduktion der Inflammation und Thrombosierung – CAVE: eine der wenigen Indikationen von ASS bei febrilen Kindern!) und i.v. Immunglobulinen (IVIG, Reduktion der Inflammation und des Risikos für Coronararterienaneurysmen -> Mechanismus unbekannt, Link). Wie bereits angesprochen ist eine gefürchtete Komplikation des unbehandelten Kawasaki-Syndroms die Ausbildung von Coronararterierenaneurysmen, welche Jahre bis Jahrzehnte später zu einem Herzinfarkt oder anderwertigen cardialen Komplikationen (HRST, Aneurysmaruptur) führen können. In dieser Fallsammlung von 117 Patienten mit plötzlichem Herztod nach durchgemachter Kawasaki-Erkrankung (Link) wurde dargelegt, dass der Großteil der Todesfälle auf ein ACS zurückzuführen war und fast 70% der Patienten in ihren 20ern oder jünger waren!
Achtung: Diese Erkenntnis hat eine praktische Konsequenz: ein Patient mit einem klassischen OMI-EKG (Link) und passender Symptomatik ist als Infarktpatient zu führen, egal wie alt der Patient ist. Das heißt auch die 18-jährige Patientin mit Thoraxschmerz und LAD-Infarktbild im EKG gehört sofort in den Herzkatheter (Link)! Die Therapie der Wahl ist die PCI (Link)! Relevant ist hierbei zusätzlich eine Anamnese zurück in die Kindheit, d.h. das gezielte Fragen nach Symptomen des Kawasaki-Syndroms. Selbst wenn diese verneint werden ist das noch keine Bestätigung, dass das Kawasaki-Syndrom doch nicht die Ursache des RCA-Infarktes ist. In dieser Arbeit z.B. wurde das Kawasaki-Syndrom erst per Autopsie als Ursache des Infarktes bestätigt – der 24-jährige Patient hatte keine typischen Symptome aus der Kindheit angegeben. Selbst Kleinkinder wurden aufgrund eines Infarktes basierend auf einem Kawasaki-Syndroms bereits in die PCI geschoben (Link), bis hin zur Bypass-OP (Link)! Merke: typisches Infarkt-EKG + passende Symptomatik = Akut-PCI, egal wie alt der Patient ist!
Tako-Tsubo-Syndrom
Die Tako-Tsubo-Cardiomyopathie (Broken-Heart-Syndrom) ist eine durch emotionale oder physische Belastung akut hervorgerufene reversible Dysfunktion des li. Ventrikels besonders apikal. Dies zeigt sich durch Ballooning-Effekte in der Echocardiographie, PCI oder im MRT, die in ihrer Form einer japanischen Tintenfischfalle namens Tako Tsubo ähneln. Pathophysiologisch scheinen Coronarspasmen oder eine Catecholamin-assoziierte mikrovaskuläres Dysfunktion zugrunde liegen (Link).
Klinisch präsentieren sich die Patientinnen (v.a. ältere Damen betroffen) mit Symptomen eines akuten Coronarsyndroms (Brustenge, Angina Pectoris, Übelkeit, Arrhythmien) und / oder einer akuten cardialen Dekompensation (Dyspnoe, Lungenödem). Mitunter kann es sogar zu einer Synkope kommen. Im EKG zeigen sich ischämische Hinweise wie bei OMI-NOMI (z.B. ST-Hebung) oder Arrhythmien, im Labor ist das Troponin erhöht. Auch das Pickelhaubenzeichen kann sichtbar sein.
Die folgenden EKGs sind von einer ca. 60-jährigen Patientin aus einem meiner Einschulungsdienste zum Notarzt. Sie klagte nach körperlicher Belastung über stechende Brustschmerzen, war xABCDE inkl. Vitalwerten komplett stabil und hatte keine Allergien oder eingenommene Medikamente. Bekannt war ein Tako-Tsubo-Syndrom (TTS) vor Jahren. Mein supervidierender Notarzt und ich tippten auf das Tako-Tsubo-Syndrom, behandelten die Patientin aber im Zweifel als ACS (UFH, ASS, Ticagrelor, sofortiger Transfer ad PCI). In der PCI bestätigte sich ein TTS und eine Entlassung aus dem Spital konnte nach wenigen Tagen veranlasst werden.
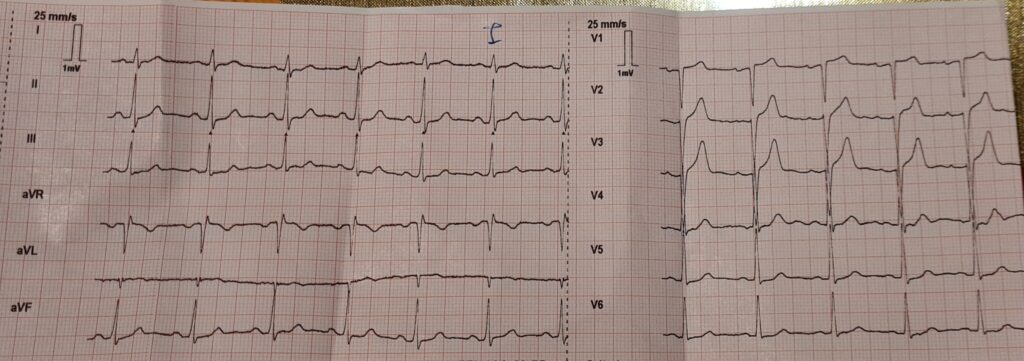
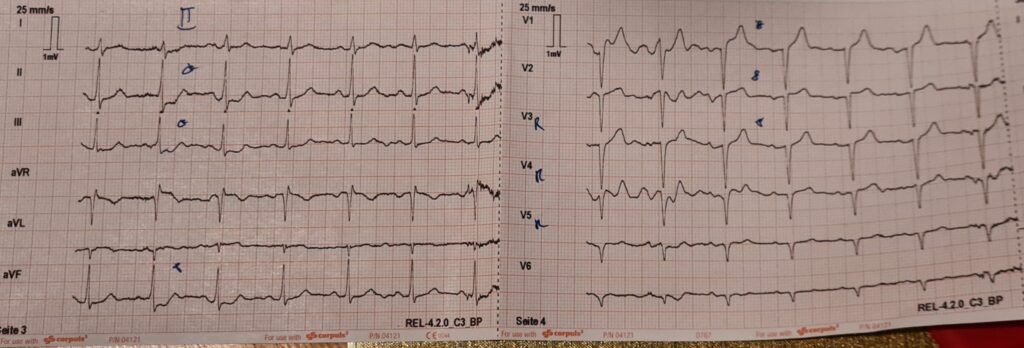
Die initiale Therapie ist symptomatisch und entspricht jener des ACS, da eine Differenzierung Tako-Tsubo vs. ACS ausschließlich im Herzkatheter möglich ist. Bei völliger Unklarheit in der PCI kann auch ein MRT des Herzens durchgeführt werden (z.B. zum differentialdiagnostischen Ausschluss einer Myocarditis). Eine großartige Übersicht gibt es hier und hier. Ist die Diagnose Tako-Tsubo gesichert wird die Therapie erweitert:
- optimierte Flüssigkeitsgabe
- Inotropie (z.B. Dobutamin, Levosimendan)
- Vorlastsenkung (z.B. Glyceroltrinitrat)
- Nachlastsenkung (z.B. Urapidil)
- Diurese (z.B. Furosemid)
Bei Vorliegen einer dynamischen Obstruktion des linksventrikulären Ausflusstraktes (LVOT) dürfen positive Inotropika sowie Vor- und Nachlastsenker nicht injiziert werden, da diese zu einer Verschlechterung führen (das anteriore Mitralsegel wird noch intensiver in Richtung LVOT gezogen) – hier sind primär β-Blocker zu bevorzugen (z.B. Esmolol), bei Hypotonie mit äußerster Vorsicht der α1-Agonist Phenylephrin (keine direkt positiven inotropen Eigenschaften, Reduktion der Herzfrequenz durch Stimulation von Barorezeptoren, Verlängerung der Diastole mit besserer Herzperfusion, siehe unseren Beitrag). Bei Therapierefraktärität können mechanische Maßnahmen ergriffen werden (z.B. linksventrikuläres Assistdevice ~ LVAD), wiewohl die Prognose generell günstig ist. Nach hämodynamischer Stabilisierung wird eine Therapie mit ACE-Hemmern oder AT1-Antagonisten bis zur endgültigen Resolution empfohlen.
Schreibe einen Kommentar